Хиты продаж
-
799,48 грн.Ксеникал капс 120мг №21 орлистат -

1335,84 грн.Синемет(Карбидопа и леводопа) таб. 25мг +250мг №50 -
1518,00 грн.Блеоцел (Блеомицин) 15мг №1 -

2934,80 грн.Кортеф 10мг №100 -
7772,16 грн.Ретиналамин 5мг №10 ліоф.
Оземпик 0,5 мг №1 семаглутид шприц-ручка
Главная » Каталог лекарств
- Код товара: s264078
- Действующее вещество: семаглутид
- Наличие: есть в наличии
Цена: 8602,00 грн. В корзину
Склад
діюча речовина: семаглутид;
1 мл розчину містить 1,34 мг семаглутиду – аналога людського глюкагоноподібного пептиду-1 (ГПП-1), виготовленого у Saccharomyces cerevisiae за технологією рекомбінантної ДНК;
одна попередньо заповнена шприц-ручка містить 4 мг семаглутиду 3,0 мл розчину. Шкірна доза містить 1 мг семаглутиду у 0,74 мл розчину;
допоміжні речовини: натрію гідрофосфат, дигідрат; пропіленгліколь; фенол; кислота хлористоводнева (для корекції pH); натрію гідроксид (для корекції pH); вода для ін'єкцій.
Лікарська форма
Розчин для ін'єкцій.
Основні фізико-хімічні властивості: прозрачний та безбарвний або майже безбарвний ізотонічний розчин; рН = 7,4.
Фармакотерапевтична група
Препарати, що застосовуються при цукровому діабеті, є аналогами глюкагоноподібного пептиду-1 (ГПП-1). Код ATХ A10B J06.
Фармакологічні властивості
Фармакодинамика.
Механізм дії
Семаглутид є аналогом ГПП-1 з 94% гомологічністю до ГПП-1 людини. Семаглутид діє як агоніст рецепторів ГПП?1, що селективним чином зв'язується та активує рецептори ГПП?1, які є мішенню для нативного ГПП?1.
ГПП?1 є фізіологічним гормоном, що багатьма шляхами впливає на регуляцію концентрації глюкози та апетит, а також на сердечно-судинну систему. Вплив на концентрацію глюкози та апетит специфічно опосередкований рецепторами ГПП?1, що розташовуються у підшлункової залозі та головному мозку.
Семаглутид знижує рівень глюкози в крові, діючи глюкозолежним чином, стимулюючи секрецію інсуліну і пригнічуючи секрецію глюкагону за умови підвищеної концентрації глюкози в крові. Механізм зниження рівня глюкози в крові також супроводжується незначною затримкою випорожнення шлунка протягом ранньої постпрандіальної фази. При гіпоглікемії семаглутид зменшує секрецію інсуліну і не перешкоджає секреції глюкагону.
Застосування семаглутиду призводить до зменшення маси тіла та маси жирової тканини шляхом зменшення споживання калорій, а також зниження апетиту. Крім того, семаглутид знижує потяг до їжі з високим вмістом жирів.
Експресія ГПП?1 рецепторів відбувається також у серці, судинній системі, імунній системі та у почках.
У ході клінічних досліджень семаглутид позитивно впливав на рівні ліпідів у плазмі крові, знижував систолічний артеріальний тиск і зменшував запалення. У випробуваннях на тваринах семаглутид пригнічує розвиток атеросклерозу, запобігаючи прогресуванню аортальних бляшок та зменшуючи запалення у бляшках.
Фармакодинамічні ефекти
Усі фармакодинамічні випробування проводилися після 12 нед лікування (включаючи підвищення дози) у рівноважному стані при застосуванні семаглутиду у дозі 1 мг один раз на тиждень.
Рівень глюкози на товщі та постпрандіальний рівень глюкози.
Семаглутид призводить до зменшення концентрації глюкози на натще та постпрандіальної концентрації глюкози. У пацієнтів із сахарним діабетом 2-го типу лікування семаглутидом у дозі 1 мг призводило до зменшення концентрації глюкози з точки зору абсолютної зміни від початкового рівня (ммоль/л) та відносного зменшення у порівнянні з плацебо (%) за параметрами концентрації глюкози на натще (1,6 ммоль/л; 37 %), середньої добової концентрації глюкози (1,7 ммоль/л; 22 %) та коливання постпрандіальної концентрації глюкози протягом трьох прийомів їжі (0,6–1,1 ммоль/л) у порівнянні з плацебо. Семаглутид знижував рівень глюкози на натще після першого застосування.
Функція бета-клітин і секреція інсуліну
Семаглутид покращує функцію бета-клітин. У порівнянні з плацебо семаглутид покращував першу та другу фазу відповіді інсуліну з трикратним і двократним підвищенням відповідно, а також збільшував максимальну секреторну активність бета-клітин у пацієнтів із цукровим діабетом 2-го типу. Крім того, порівняно з плацебо лікування семаглутидом призводило до збільшення концентрації інсуліну на натще.
Секреція глюкагону
Семаглутид зменшує концентрацію глюкагону на натще і постпрандіальну концентрацію глюкагону. У пацієнтів із сахарним діабетом 2-го типу застосування семаглутиду призводило до відносного зниження концентрації глюкагону в порівнянні з плацебо: концентрація глюкагону на натще (8–21 %), постпрандіальна відповідь глюкагону (14–15 %) та середня суткова концентрація глюкагону (12 %).
Глюкозозалежна секреція інсуліну та глюкагону
Семаглутид знижував високу концентрацію глюкози у крові шляхом стимуляції секреції інсуліну та зниження секреції глюкагону, діючи глюкозолежним чином. Швидкість секреції інсуліну після застосування семаглутиду у пацієнтів із цукровим діабетом 2-го типу можна порівняти з такою у здорових осіб.
При індукованій гіпоглікемії семаглутид у порівнянні з плацебо не змінював контррегуляторну реакцію підвищення рівня глюкагону і не посилював зниження концентрації C-пептиду у пацієнтів із сахарним діабетом 2-го типу.
Випорожнення шлунка
Семаглутид спричиняв незначну затримку раннього постпрандіального випорожнення шлунка, тим самим зменшуючи швидкість надходження глюкози в дах протягом постпрандіального періоду.
Апетит, споживання калорій та вибір продуктів харчування
У порівнянні з плацебо семаглутид призводив до зменшення споживання калорій на 18–35 % під час трьох послідовних довільних прийомів їжі ad libitum. Цьому сприяли індуковане семаглутидом пригнічення апетиту як на натще, так і в постпрандіальний період, покращення контролю за вживанням їжі, послаблення потягу до перекусів та відносно менше потяг до їжі з високим вмістом жирів.
Ліпіди наще та у постпрандіальний період
У порівнянні з плацебо семаглутид зменшував концентрації тригліцеридів на товщі та холестерину ліпопротеїнів дуже низької щільності (ЛПДНЩ) на 12 % та 21 % відповідно. Постпрандіальна реакція тригліцеридів та реакція холестерину ЛПДНЩ на їжу з високим вмістом жирів зменшувалися більш ніж на 40 %.
Електрофізіологія серця (QTc)
Вплив семаглутиду на процес реполяризації у серці перевірявся у ході ретельного дослідження QTc. Семаглутид не продовжував інтервалу QTc у дозах до 1,5 мг у рівноважному стані.
Клінічна ефективність та безпека
Як покращення глікемічного контролю, так і зниження серцево-судинної захворюваності та смертності є невід'ємною складовою терапії цукрового діабету 2-го типу.
Ефективність та безпеку застосування семаглутиду у дозах 0,5 мг та 1 мг один раз на тиждень оцінювали у шести рандомізованих контрольованих клінічних дослідженнях фази 3a за участю 7215 пацієнтів із сахарним діабетом 2-го типу (семаглутид отримували 4107 пацієнтів). Головною метою п'яти клінічних випробувань (SUSTAIN 1–5) була оцінка ефективності глікемічного контролю, а одного випробування (SUSTAIN 6) – серцево-судинних наслідків лікування.
Було проведено додаткове клінічне випробування фази 3b (SUSTAIN 7) за участю 1201 пацієнта з метою порівняння ефективності та безпеки застосування семаглутиду у дозах 0,5 мг та 1 мг один раз на тиждень із прийомом дулаглутиду у дозах 0,75 мг та 1,5 мг відповідно один раз на тиждень. Випробування фази 3b (SUSTAIN 9) було проведено для дослідження ефективності та безпеки застосування семаглутиду як доповнення до лікування інгібітором натрійзалежного котранспортера глюкози 2 типу (іНЗКТГ-2).
Лікування семаглутидом продемонструвало стійке, статистично більш вагоме та клінічно значуще зниження показників HbA 1c та маси тіла протягом періоду до двох років у порівнянні з плацебо та активним контрольованим лікуванням (ситагліптин, інсулін гларгін, ексенатид ER та дулаглутид).
Ефективність семаглутиду не залежала від віку, статі, раси, етнічного походження, вихідного ІМТ, вихідної маси тіла (кг), тривалості цукрового діабету та ступеня порушення функції нірок пацієнта.
Значення досягли цільових результатів дослідження у всіх рандомізованих групах пацієнтів (аналізи на основі змішаних моделей для повторних вимірювань або багаторазового умовного розрахунку).
Крім того, було проведено дослідження фази 3b (SUSTAIN 11) для вивчення ефекту семаглутиду порівняно з ефектом інсуліну аспарт як доповнення до метформіну та оптимізованого інсуліну гларгін (100 ОД).
Більш детальну інформацію можна знайти нижче.
Випробування SUSTAIN 1. Монотерапія
У підвійно сліпому плацебо-контрольованому клінічному дослідженні тривалістю 30 тижнів 388 пацієнтів з недостатнім контролем захворювання при застосуванні дієти та фізичних вправ були рандомізовані у групи прийому один раз на тиждень семаглутиду 0,5 мг або 1 мг або плацебо.
Таблиця 1
Дослідження SUSTAIN 1: результати на 30-й тиждень
Показник
Семаглутід
0,5 мг
Семаглутід
1 мг
Плацебо
Кількість пацієнтів
128
130
129
HbA 1c (%)
На початку (середнє значення)
8,1
8,1
8,0
Зміна від початку до 30 тижнів
- 1,5
- 1,6
0
Різниця у порівнянні з плацебо (95 % ДІ)
- 1,4 [-1,7,
- 1,1] a
- 1,5 [-1,8, -1,2] a
-
Пацієнти (%), що досягли HbA 1c < 7 %
74
72
25
Глюкоза в плазмі наще (ммоль/л)
На початку (середнє значення)
9,7
9,9
9,7
Зміна від початку до 30 тижнів
- 2,5
- 2,3
- 0,6
Маса тіла (кг)
На початку (середнє значення)
89,8
96,9
89,1
Зміна від початку до 30 тижнів
- 3,7
- 4,5
- 1,0
Різниця з плацебо (95 % ДІ)
- 2,7 [-3,9,
- 1,6] a
- 3,6 [-4,7, -2,4] a
-
a p < 0,0001 (двохсторонній) для переваги.
Клінічне випробування SUSTAIN 2. Семаглутид у порівнянні з ситагліптином, обидва у комбінації з одним-двома пероральними протидіабетичними лікарськими засобами (метформіном та/або тіазолідиндіонами)
У підвійно сліпому з активним контролем дослідження тривалістю 56 тижнів 1231 пацієнта рандомізували в групи прийому або семаглутиду 0,5 мг один раз на тиждень або 1 мг один раз на тиждень, або ситагліптину 100 мг один раз на день; всі у комбінації з метформіном (94 %) та/або тіазолідиндіонами (6 %).
Таблиця 2
Дослідження SUSTAIN 2: результати на 56-й тиждень
Показник
Семаглутід
0,5 мг
Семаглутід
1 мг
Сітагліптин 100 мг
Кількість пацієнтів
409
409
407
HbA 1c (%)
На початку (середнє значення)
8,0
8,0
8,2
Зміна від початку до 56-го тижня
- 1,3
- 1,6
- 0,5
Різниця у порівнянні з ситагліптином (95 % ДІ)
- 0,8 [-0,9, -0,6] a
- 1,1 [-1,2,
- 0,9] a
-
Пацієнти (%), що досягли HbA 1c < 7 %
69
78
36
Глюкоза в плазмі наще (ммоль/л)
На початку (середнє значення)
9,3
9,3
9,6
Зміна від початку до 56-го тижня
- 2,1
- 2,6
- 1,1
Маса тіла (кг)
На початку (середнє значення)
89,9
89,2
89,3
Зміна від початку до 56-го тижня
- 4,3
- 6,1
- 1,9
Різниця у порівнянні з ситагліптином (95 % ДІ)
- 2,3 [-3,1, -1,6] a
- 4,2 [-4,9,
- 3,5] a
-
a p < 0,0001 (двохсторонній) для переваги.
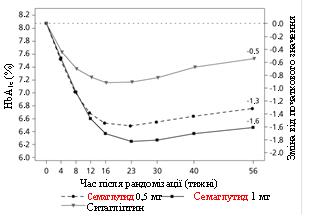
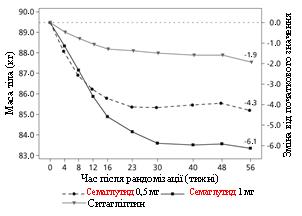
Мал. 1. Середня зміна HbA 1c (%) та маси тіла (кг) від початку до 56-го тижня.
Клінічне дослідження SUSTAIN 7. Семаглутид у порівнянні з дулаглутидом, обидва у комбінації з метформіном
Учасників відкритого клінічного дослідження відкритого типу тривалістю 40 тижнів (1201 пацієнт), які приймали метформін, рандомізували у співвідношенні 1:1:1:1 у групи прийому один раз на тиждень семаглутиду 0,5 мг або дулаглутиду 0,75 мг, або семаглутиду 1 мг, або
В випробуванні порівнювали результати застосування 0,5 мг семаглутиду з 0,75 мг дулаглутиду та 1 мг семаглутиду з 1,5 мг дулаглутиду.
Порушення з боку шлунково-кишкового тракту були найчастішими побічними реакціями, що виникали у однаковій частці пацієнтів, які отримували семаглутид 0,5 мг (129 пацієнтів [43 %]), семаглутид 1 мг (133 [44 %]) та дулаглутид 1,5 мг; у меншої кількості пацієнтів були порушення з боку шлунково-кишкового тракту при застосуванні дулаглутиду 0,75 мг (100 [33 %]).
На 40-й тиждень підвищення частоти пульсу при застосуванні семаглутиду (0,5 мг та 1 мг) та дулаглутиду (0,75 мг та 1,5 мг) становило 2,4 та 4,0 та 1,6 та 2,1 ударів на хвилину відповідно.
Таблиця 3
Дослідження SUSTAIN 7: результати на 40-й тиждень.
Показник
Семаглутід
0,5 мг
Семаглутід
1 мг
Дулаглутід
0,75 мг
Дулаглутід
1,5 мг
Кількість пацієнтів
301
300
299
299
HbA 1c (%)
На початку (середнє значення)
8,3
8,2
8,2
8,2
Зміна від початку до 40-го тижня
- 1,5
- 1,8
- 1,1
- 1,4
Різниця у порівнянні з дулаглутидом (95 % ДІ)
- 0,4 b
[-0,6, -0,2) a
- 0,4 c
[-0,6, -0,3] a
-
-
Пацієнти (%), що досягли HbA 1c < 7 %
68
79
52
67
Глюкоза в плазмі наще (ммоль/л)
На початку (середнє значення)
9,8
9,8
9,7
9,6
Зміна від початку до 40-го тижня
- 2,2
- 2,8
- 1,9
- 2,2
Маса тіла (кг)
На початку (середнє значення)
96,4
95,5
95,6
93,4
Зміна від початку до 40-го тижня
- 4,6
- 6,5
- 2,3
- 3,0
Різниця у порівнянні з дулаглутидом (95 % ДІ)
- 2,3 b
[-3,0, -1,5) a
- 3,6 c
[-4,3, -2,8] a
-
-
a p < 0,0001 (двохсторонній) для переваги.
b Семаглутид 0,5 мг у порівнянні з дулаглутидом 0,75 мг.
c Семаглутид 1 мг у порівнянні з дулаглутидом 1,5 мг.
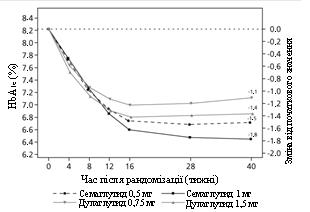
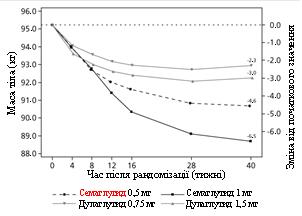
Мал. 2. Середня зміна HbA 1c (%) та маси тіла (кг) від початку до 40-го тижня.
Клінічне дослідження SUSTAIN 3. Семаглутид у порівнянні з ексенатидом ER, обидва у комбінації з метформіном або метформіном з сульфонілсечовиною
У відкритому випробуванні тривалістю 56 тижнів 813 пацієнтів, які приймали лише метформін (49 %), метформін із сульфонілсечовиною (45 %) або інші препарати (6 %), рандомізували до груп прийому семаглутиду 1 мг або ексенатиду ER 2 мг один раз на тиждень.
Таблиця 4
Дослідження SUSTAIN 3: результати на 56-й тиждень
Показник
Семаглутід
1 мг
Ексенатид ER
2 мг
Кількість пацієнтів
404
405
HbA 1c (%)
На початку (середнє значення)
8,4
8,3
Зміна від початку до 56-го тижня
- 1,5
- 0,9
Різниця у порівнянні з екзенатидом (95 % ДІ)
- 0,6 [-0,8, -0,4] a
-
Пацієнти (%), що досягли HbA 1c < 7 %
67
40
Глюкоза в плазмі наще (ммоль/л)
На початку (середнє значення)
10,6
10,4
Зміна від початку до 56-го тижня
- 2,8
- 2,0
Маса тіла (кг)
На початку (середнє значення)
96,2
95,4
Зміна від початку до 56-го тижня
- 5,6
- 1,9
Різниця у порівнянні з ексенатидом (95 % ДІ)
- 3,8 [-4,6, -3,0] a
-
a p < 0,0001 (двохсторонній) для переваги.
Клінічне дослідження SUSTAIN 4. Семаглутид у порівнянні з інсуліном гларгін, обидва у комбінації з одним-двома пероральними протидіабетичними препаратами (метформіном або метформіном із сульфонілсечовиною)
У відкритому випробуванні з препаратом порівняння тривалістю 30 тижнів 1089 пацієнтів рандомізували до груп прийому семаглутиду 0,5 мг один раз на тиждень, семаглутиду 1 мг один раз на тиждень або інсуліну гларгін один раз на день з одночасним застосуванням метформіну (48 %) або метформінувіну сульф.
Таблиця 5
Дослідження SUSTAIN 4: результати на 30-й тиждень
Показник
Семаглутід
0,5 мг
Семаглутід
1 мг
Інсулін гларгін
Кількість пацієнтів
362
360
360
HbA 1c (%)
На початку (середнє значення)
8,1
8,2
8,1
Зміна від початку до 30-го тижня
- 1,2
- 1,6
- 0,8
Різниця у порівнянні з інсуліном гларгін (95 % ДІ)
- 0,4 [-0,5,
- 0,2] a
- 0,8 [-1,0, -0,7] a
-
Пацієнти (%), що досягли HbA 1c < 7 %
57
73
38
Глюкоза в плазмі наще (ммоль/л)
На початку (середнє значення)
9,6
9,9
9,7
Зміна від початку до 30-го тижня
- 2,0
- 2,7
- 2,1
Маса тіла (кг)
На початку (середнє значення)
93,7
94,0
92,6
Зміна від початку до 30-го тижня
- 3,5
- 5,2
+1,2
Різниця у порівнянні з інсуліном гларгін (95 % ДІ)
- 4,6 [-5,3,
- 4,0] a
- 6,34 [-7,0,
- 5,7] a
-
a p < 0,0001 (двохсторонній) для переваги.
Клінічне дослідження SUSTAIN 5. Семаглутиду порівняно з плацебо, обидва у комбінації з базальним інсуліном
У підвійно сліпому плацебо контрольованому дослідженні тривалістю 30 тижнів 397 пацієнтів з недостатнім контролем при лікуванні базальним інсуліном без застосування чи із застосуванням метформіну рандомізували до груп прийому семаглутиду 0,5 мг один раз на тиждень, семаглутиду 1 мг один раз на тиждень або плаце.
Таблиця 6
Дослідження SUSTAIN 5: результати на 30-й тиждень
Показник
Семаглутід
0,5 мг
Семаглутід
1 мг
Плацебо
Кількість пацієнтів
132
131
133
HbA 1c (%)
На початку (середнє значення)
8,4
8,3
8,4
Зміна від початку до 30-го тижня
- 1,4
- 1,8
- 0,1
Різниця у порівнянні з плацебо (95 % ДІ)
- 1,4 [-1,6, -1,1] a
- 1,8 [-2,0, -1,5] a
-
Пацієнти (%), що досягли HbA 1c < 7 %
61
79
11
Глюкоза в плазмі наще (ммоль/л)
На початку (середнє значення)
8,9
8,5
8,6
Зміна від початку до 30-го тижня
- 1,6
- 2,4
- 0,5
Маса тіла (кг)
На початку (середнє значення)
92,7
92,5
89,9
Зміна від початку до 30-го тижня
- 3,7
- 6,4
- 1,4
Різниця у порівнянні з плацебо (95 % ДІ)
- 2,3 [-3,3, -1,3] a
- 5,1 [-6,1, -4,0] a
-
a p < 0,0001 (двохсторонній) для переваги.
Клінічне дослідження SUSTAIN 9. Семаглутид у порівнянні з плацебо, обидва з доповненням до інгібітора НЗКТГ-2±метформін або сульфонілсечовина
У підвійно сліпому плацебо контролованому дослідженні тривалістю 30 тижнів 302 пацієнтів з недостатнім контролем при лікуванні інгібітором НЗКТГ-2 без застосування чи із застосуванням метформіну або сульфонілсічовини рандомізували у групи прийому семаглутиду 1,0 мг один раз на тиждень або
Таблиця 7
Дослідження SUSTAIN 9: результати на 30-й тиждень
Показник
Семаглутід
1 мг
Плацебо
Кількість пацієнтів
151
151
HbA 1c (%)
На початку (середнє значення)
8,0
8,1
Зміна від початку до 30-го тижня
- 1,5
- 0,1
Різниця у порівнянні з плацебо (95 % ДІ)
- 1,4 [-1,6, -1,2] a
-
Пацієнти (%), що досягли HbA 1c < 7 %
78.7
18.7
Глюкоза в плазмі наще (ммоль/л)
На початку (середнє значення)
9,1
8,9
Зміна від початку до 30-го тижня
- 2,2
0.0
Маса тіла (кг)
На початку (середнє значення)
89,6
93,8
Зміна від початку до 30-го тижня
- 4,7
- 0,9
Різниця у порівнянні з плацебо (95 % ДІ)
- 3,8 [-4,7, -2,9] a
-
a p < 0,0001 (двобічний) для переваги, скоригування щодо множинності на основі ієрархічного тестування значення HbA 1c та маси тіла.
Клінічне дослідження SUSTAIN 11 – Семаглутид у порівнянні з інсулін аспарт як доповнення до інсуліну гларгін + метформін
У 52-тижневому відкритому дослідженні 1748 пацієнтів із недостатньо контрольованим сахарним діабетом 2-го типу після 12-тижневого періоду введення інсуліну гларгін та метформіну були рандомізовані у співвідношенні 1:1 для отримання семаглутиду один раз на тиждень (0,5 мг або ін. Включена популяція мала середню тривалість діабету 13,4 року та середній HbA 1c 8,6 %, з цільовим HbA 1c 6,5–7,5 %.
Лікування семаглутидом призвело до зниження HbA 1c на 52-й неділі (-1,5 % для семаглутиду порівняно з -1,2 % для інсуліну аспартат).
Кількість епізодів тяжкої гіпоглікемії в обох групах лікування була низькою (4 епізоди при застосуванні семаглутиду порівняно з 7 епізодами при застосуванні інсуліну аспартат).
Середня вихідна маса тіла зменшилася при застосуванні семаглутиду (-4,1 кг) і зросла при застосуванні інсуліну аспарт (+2,8 кг), передбачувана різниця залежно від лікування становила -6,99 кг (95 % ДІ від -7,41 до -6,57) на 52 неділі.
Комбіноване застосування з монотерапією сульфонілсічовиною.
У клінічному випробуванні SUSTAIN 6 (див. підрозділ «Серцево-судинні захворювання») 123 пацієнти на початку застосовували монотерапію сульфонілсечовиною. Початковий показник HbA 1c становить 8,2 %, 8,4 % та 8,4 % при застосуванні семаглутиду 0,5 мг, семаглутиду 1 мг та плацебо відповідно. Через 30 тижнів показник HbA 1c знизився на 1,6 %, 1,5 % при застосуванні семаглутиду 0,5 мг, семаглутиду 1 мг відповідно та збільшився на 0,1 % при застосуванні плацебо.
Комбіноване застосування з премікс інсуліном ± один-два ПЦЗП (пероральний цукрозніжувальний препарат).
У дослідженні SUSTAIN 6 (див. підрозділ «Серцево-судинне захворювання») 867 пацієнтів застосовували премікс інсулін (на початку разом із ПЦЗП або без них). Початковий показник HbA 1c становить 8,8 %, 8,9 % та 8,9 % при застосуванні семаглутиду 0,5 мг, семаглутиду 1 мг та плацебо відповідно. Через 30 тижнів показник HbA 1c знизився на 1,3 %, 1,8 % та 0,4 % при застосуванні семаглутиду 0,5 мг, семаглутиду 1 мг та плацебо відповідно.
Серцево-судинне захворювання.
У підвійно сліпому клінічному дослідженні тривалістю 104 тижні (SUSTAIN 6) 3297 пацієнтів із сахарним діабетом 2-го типу з високим серцево-судинним ризиком рандомізували у групи прийому семаглутиду 0,5 мг або семаглутид 1 мг один раз на тиждень або плацебо у доповнення. Загалом 98 % пацієнтів завершили випробування і наприкінці показники життєво важливих функцій були наявні для 99,6 % з них.
Популяція у дослідженні розподілилися за віком таким чином: 1598 пацієнтів (48,5 %) віком ≥ 65 років, 321 (9,7 %) – віком ≥ 75 років та 20 (0,6 %) – віком ≥ 85 років. У 2358 пацієнтів функція нірок була нормальною або з порушеннями легкого ступеня, 832 пацієнти мали порушення функції нірок помірного ступеня і 107 – тяжкого ступеня або кінцеву стадію ніркової недостатності. У популяції був 61 % чоловіків, середній вік яких становив 65 років, а середній ІМТ – 33 кг/м 2 . Середня тривалість захворювання на цукровий діабет становила 13,9 року.
Первинною кінцевою точкою була година від рандомізації до першого виникнення серйозного несприятливого серцево-судинного явища (MACE): смерть через серцево-судинне захворювання, нелетальний інфаркт міокарда або нелетальний інсульт.
Сумарний показник за складовою первинної кінцевої точки MACE становить 254, включаючи 108 (6,6 %) при застосуванні семаглутиду та 146 (8,9 %) – плацебо. Див. малюнок 4, на якому позначено результати за первинною та вторинними сердечно-судинними кінцевими точками. Лікування семаглутидом призвело до зменшення на 26 % ризику наступу комбінованої первинної кінцевої точки щодо смерті через серцево-судинні захворювання, нелетальний інфаркт міокарда та нелетальний інсульт. Загальна кількість смертей від серцево-судинних захворювань, нелетального інфаркту міокарда або нелетального інсульту становила 90, 111 та 71 відповідно, включаючи 44 (2,7 %), 47 (2,9 %) та 27 (1,6 %) випадків відповідно до застосування семаглутиду (рисунок). Зниження ризику в первинній комбінованій точці головним чином було зумовлене зменшенням частоти випадків нелетального інсульту (39 %) та нелетального інфаркту міокарда (26 %) (рисунок 3).
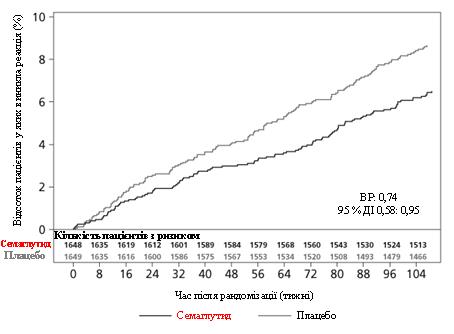
Мал. 3. Графік Каплана – Майєра щодо години до настання першої композитної події: смерть через серцево-судинне захворювання, нелетальний інфаркт міокарда та нелетальний інсульт (клінічне дослідження SUSTAIN 6).
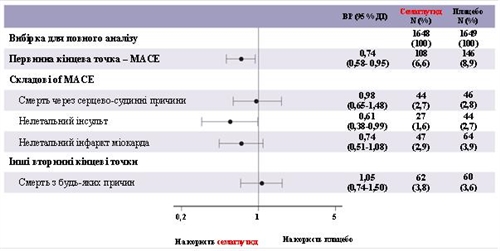
Мал. 4. Форест-діаграма: аналіз часу до настання першої композитної події, її складові та випадки смерті з будь-яких причин (дослідження SUSTAIN 6).
Було зареєстровано 158 випадків нефропатії, яку було діагностовано вперше або яка посилилася. ВР [95 % ДІ] години до виникнення нефропатії, що визначається стійкою макроальбумінурією (перше виникнення явища стійкої макроальбумінурії, стійкого двократного рівня креатиніну в сироватці крові, потреби у безперервній замісній нірковій терапії та смерті через захворювання нірок), становивши 0,6; 0,88].
Маса тіла.
Через рік лікування втрата маси тіла на рівні ≥ 5 % та ≥ 10 % спостерігалася у більшої кількості пацієнтів при застосуванні семаглутиду 0,5 мг (46 % та 13 %) та 1 мг (52–62 % та 21–24 %), ніж при застосуванні активного компаратора ситагліптину (18 % та 3 % та 3)
У дослідженні порівняння з дулаглутидом, що тривало 40 нед, втрата маси тіла на рівні ≥ 5 % та ≥ 10 % була досягнута у більшої кількості пацієнтів при застосуванні семаглутиду 0,5 мг (44 % та 14 %), ніж дулаглутиду 0,75 мг (23 % та 3 7%) ніж дулаглутиду 1,5 мг (30% та 8%).
У ході клінічного випробування SUSTAIN 6 спостерігалося суттєве та стійке зменшення маси тіла від початку лікування до 104 тижні при застосуванні семаглутиду 0,5 мг та 1 мг у порівнянні з плацебо 0,5 мг та 1 мг при доповненні до стандартного лікування (- 3,6 кг та ?4,9 кг у порівнянні з -0.
Артеріальний тиск.
Наблюдалось значне зниження середнього систолічного артеріального тиску при застосуванні семаглутиду 0,5 мг (3,5–5,1 мм рт. ст.) та 1 мг (5,4–7,3 мм рт. ст.) у комбінації з пероральними протидіабетичними лікарськими засобами або з базальним інсулі. Не було зазначено значної різниці за показником діастолічного артеріального тиску між лікуванням із застосуванням семаглутиду та препаратів порівняння.
Діти
Європейське агентство з лікарських засобів відтермінувало зобов'язання подавати результати досліджень застосування лікарського засобу Оземпік в одній або кількох підгрупах педіатричних пацієнтів при лікуванні цукрового діабету 2-го типу (див. розділ «Спосіб застосування та дози»).
Фармакокінетика.
У порівнянні з нативним ГПП?1 семаглутид характеризується довженим періодом напіввиведення тривалістю 1 тиждень, що забезпечує його можливість введення підшкірно один раз на тиждень. Провідним механізмом такої пролонгованої дії є зв'язування з альбуміном, що призводить до зменшення почкового кліренсу та захисту від метаболічної деградації. Крім того, семаглутид стабілізується від деградації ферментом DPP-4.
Абсорбція.
Максимальна концентрація досягається протягом 1-3 днів після введення препарату. Рівноважна концентрація досягається через 4–5 нед після застосування препарату за схемою один раз на тиждень. У пацієнтів із цукровим діабетом 2-го типу середня рівноважна концентрація після підшкірного введення 0,5 мг та 1 мг семаглутиду становила приблизно 16 нмоль/л та 30 нмоль/л відповідно. При застосуванні доз 0,5 мг та 1 мг експозиція семаглутиду зростала дозозалежним чином. Схожа експозиція була досягнута при підшкірному введенні семаглутиду в ділянку передньої черевної стінки, стегна або плеча. Абсолютна біодоступність семаглутиду після його підшкірного введення становила 89 %.
Розподіл.
Середній об'єм розподілу семаглутиду після підшкірного введення у пацієнтів із цукровим діабетом 2-го типу становив приблизно 12,5 л. Семаглутид у значній мірі зв'язувався з альбуміном плазми крові (> 99 %).
Метаболізм.
Перед екскрецією семаглутид активно метаболізується шляхом протеолітичного розщеплення пептидної основи білка та наступного бета-окислення жирнокислотної бічної цепочки. Припускається, що у метаболізмі семаглутиду задіяний фермент нейтральної ендопептидази (НЕП).
Виведення
У дослідженні із підшкірним веденням одноразової дози семаглутиду, міченого радіоактивним ізотопом, виявлено, що пов'язане із семаглутидом речовина виводиться головним чином із сечею та фекаліями; приблизно 2/3 пов'язаного із семаглутидом речовини виводилося з сечею і приблизно 1/3 – з фекаліями. Приблизно 3 % введеної дози виводилося із сечею у вигляді незміненого семаглутиду. У пацієнтів із цукровим діабетом 2-го типу кліренс семаглутиду становив приблизно 0,05 л/год. При своєму періоді напіввиведення тривалістю приблизно 1 тиждень семаглутид присутній у кровообігу протягом 5 нед після введення його останньої дози.
Особливі групи пацієнтів
Пацієнти літнього віку
З огляду на дані, отримані в ході випробувань фази За участю пацієнтів віком 20–86 років, вік не впливає на фармакокінетику семаглутиду.
Стати, раса та етнічна приналежність
Стати, раса (європеоїдна, негроїдна чи монголоїдна) та етнічна приналежність (іспанського чи латиноамериканського походження, не іспанського чи не латиноамериканського походження) не впливали на фармакокінетику семаглутиду.
Маса тіла.
Маса тіла впливала на експозицію семаглутиду. Більш висока маса тіла призводить до нижчої експозиції; різниця маси тіла окремих пацієнтів на рівні 20 % приводить до майже 16 % різниці в експозиції. Дози семаглутиду 0,5 мг та 1 мг забезпечують достатню системну експозицію при масі тіла у діапазоні 40-198 кг.
Порушення функції нірок
Порушення функції нірок не впливало клінічно значним чином на фармакокінетику семаглутиду. Це було продемонстровано при введенні однократної дози 0,5 мг семаглутиду у пацієнтів з порушенням функції нірок різного ступеня тяжкості (легкого, помірного, тяжкого та у пацієнтів на діалізі) у порівнянні з пацієнтами з нормальною функцією нірок. Це було також засвідчено даними клінічних випробувань фази За у пацієнтів із цукровим діабетом 2-го типу та з порушенням функції нірок, хоча досвід застосування пацієнтам із термінальною стадією захворювання нірок був обмеженим.
Порушення функції печінки.
Порушення функції печінки жодним чином не впливало на експозицію семаглутиду. У ході досліджень із введенням однократної дози 0,5 мг семаглутиду оцінювали фармакокінетику семаглутиду у пацієнтів з різним ступенем порушення функції печінки (легкого, помірного, тяжкого) у порівнянні з пацієнтами з нормальною функцією печінки.
Діти
Дослідження застосування семаглутиду педіатричним пацієнтам не проводилось.
Доклінічні дані з безпеки
Доклінічні дані, що базуються на дослідженнях з фармакологічної безпеки, токсичності повторних доз та генотоксичності, не виявили жодного ризику для людини.
Нелетальні опухоли, що походять з C-клітин щитовидної залози та які спостерігалися у гризунів, належать до ефектів, характерних для класу агоністів рецепторів ГПП?1. У дослідженні канцерогенності на щурах і мишах тривалістю 2 роки семаглутид при клінічно значних рівнях експозиції спричиняв виникнення C-клітинних опухолей щитовидної залози. Жодні інші опухоли, виникнення яких могло бути пов'язане з лікуванням, не спостерігалися. Опухоли у гризунів обумовлені негенотоксичним специфічним ГПП-1-рецептор-опосредкованим механізмом, до якого частично чутливі гризуні. Значність цього механізму для людей досить низька, але не може бути повністю виключена.
У ході досліджень фертильності у щурів семаглутид не впливав на ефективність спарювання чи на фертильність у самців. У самців щурів спостерігалося збільшення тривалості екстрального циклу і невелике зменшення жовтих тіл (овуляцій) при дозах, що супроводжувалися втратою маси тіла у самців.
В дослідженнях розвитку ембріонів і плодів на щурах семаглутид спричиняв ембріотоксичну дію при експозиції, що була нижчою за клінічно важливі рівні. Семаглутид спричиняв помітне зменшення маси тіла у самоць і зменшення показників виживання і зростання ембріонів. У плодах спостерігалися великі скелетні та вісцеральні вади розвитку, включаючи зміни у довгих кістках, ребрах, хребті, кістках хвоста, кров'яних судинах та шлуночках головного мозку. Механістична оцінка засвідчила, що ембріотоксичний ефект включає опосередковане рецепторами ГПП?1 порушення постачання поживних речовин до ембріона вдоль жовткового мішка у щурів. Через відмінності анатомічної будови жовткового мішка та його функцій у різних видів щурів і через нестачу експресії рецепторів ГПП?1 у жовткового мішка у нелюдиноподібних приматів цей механізм вважається маловірогідним для організму людини. Однак можливість безпосереднього впливу семаглутиду на плід виключити не можна.
В дослідженнях токсичного впливу препарату на розвиток кролів та яванських макак при клінічно значущих рівнях експозиції спостерігалося збільшення частоти випадків втрати вагітності та деяке підвищення частоти випадків аномалій плода. Такі результати збігалися з помітною втратою маси тіла у самців, що сягала 16 %. Невідомо, чи пов'язані такі ефекти зі зменшенням споживання самицями їжі внаслідок безпосереднього впливу ГПП?1.
Постнатальний ріст та розвиток оцінювали на ямайських яванських макаках. Дитина були трохи меншими при народженні, але їх маса тіла нормалізувалася в період грудного вигодовування.
У молодих щурів семаглутид спричиняв затримку полового дозрівання як у самців, так і у самців. Така затримка не впливала ані на фертильність та репродуктивну здатність обох статей, ані на здатність самих зберігати вагітність.
Показання
Лікарський засіб Оземпік застосовують при недостатньо контролованому цукровому діабеті 2-го типу як доповнення до дієти та фізичних вправ.
- як монотерапію, коли метформін вважається недоцільним препаратом через непереносимість чи протипоказання;
- як доповнення до інших лікарських засобів для лікування цукрового діабету
Інформацію про результати досліджень застосування комбінацій препаратів, впливу на глікемічний контроль та серцево-судинні явища, а також щодо популяції досліджуваних пацієнтів див. у розділах «Особливості застосування», «Взаємодія з іншими лікарськими засобами та інші види взаємодій» та «Фармакодинаміка».
Протипоказання
Підвищена чутливість до діючої речовини або інших компонентів лікарського засобу (див. розділ «Склад»).
Взаємодія з іншими лікарськими засобами та інші види взаємодії
Семаглутид замедлює випорожнення шлунка і здатний впливати на швидкість абсорбції пероральних лікарських засобів, що приймаються одночасно. Семаглутид слід застосовувати з обережністю пацієнтам, які отримують пероральні лікарські засоби, що вимагають швидкого всмоктування у шлунково-кишковому тракті.
Парацетамол
За результатами оцінки фармакокінетики парацетамолу протягом стандартизованого тесту з їжею, семаглутид зменшує швидкість випорожнення шлунка. Після одночасного застосування парацетамолу із семаглутидом у дозі 1 мг показники AUC 0-60 хв та C max парацетамолу зменшувалися на 27 % та 23 % відповідно. Загальна експозиція парацетамолу (AUC 0?5год ) не змінювалася. При одночасному застосуванні парацетамолу із семаглутидом корекція дози не потрібна.
Пероральні контрацептиви
Не очікується, що семаглутид знижуватиме ефективність пероральних контрацептивів. Так, при одночасному застосуванні з пероральним контрацептивним комбінованим лікарським засобом (етинілестрадіол 0,03 мг/ левоноргестрел 0,15 мг) семаглутид клінічно значуще не впливав на загальну експозицію етінілестрадіолу та левоноргестрелу. Експозиція этинілестрадіолу не порушувалася; експозиція левоноргестрелу збільшувалася на 20 % у рівноважному стані. C max жодної з цих речовин не змінювалася.
Аторвастатин
Семаглутид не змінював загальну експозицію аторвастатину після застосування одноразової дози аторвастатину (40 мг). C max аторвастатину знижувалася на 38 %. Це було визнано клінічно неважливим.
Дігоксин
Семаглутид не змінював загальну експозицію або Cmax дигоксину після застосування одноразової дози дигоксину (0,5 мг).
Метформін
Семаглутид не змінював загальну експозицію або C max метформіну після застосування останнього по 500 мг двічі на день протягом 3,5 днів.
Варфарін
Семаглутид не змінював загальну експозицію або C max R- та S-варфарину після застосування одноразової дози варфарину (25 мг), а параметри фармакодинамики варфарину, які були виміряні за міжнародним нормалізованим співвідношенням (МНС), не змінювалися клінічно значуще. Однак на початку лікування семаглутидом у пацієнтів, які приймають варфарин чи інші похідні кумарину, рекомендовано забезпечити частий контроль МНС.
Особливості щодо застосування
Відстежування
З метою покращення відстеження біологічних лікарських засобів назва та номер серії препарату, що вводиться, мають бути чітко зазначені на упаковці.
Загальна інформація
Семаглутид не слід застосовувати пацієнтам із цукровим діабетом 1-го типу або для лікування діабетичного кетоацидозу. Семаглутид не є замінником інсуліну. Повідомлялося про розвиток діабетичного кетоацидозу у інсулінозалежних пацієнтів, які розпочинали лікування агоністом рецепторів ГПП-1 і тому швидко припиняли застосування інсуліну або швидко зменшували його дозу (див. розділ «Спосіб застосування та дози»).
Немає клінічного досвіду лікування пацієнтів із застійною серцевою недостатністю ІV класу за класифікацією Нью-Йоркської асоціації кардіологів (NYHA), тому семаглутид не рекомендовано застосовувати цим пацієнтам.
Вплив на шлунково-кишковий тракт
Застосування агоністів рецепторів ГПП?1 може супроводжуватися виникненням побічних реакцій з боку шлунково-кишкового тракту. Це потрібно враховувати при лікуванні пацієнтів з порушенням функції нірок, оскільки тошнота, блювання та діарея можуть спричинити дегідратацію, що може призвести до погіршення функції нірок (див. розділ «Побічні реакції»).
Гострий панкреатит
Наблюдались випадки гострого панкреатиту при застосуванні агоністів рецепторів ГПП-1.
Пацієнтів слід проінформувати про характерні симптоми гострого панкреатиту. При підозрі на панкреатит слід відмінити лікування семаглутидом; якщо панкреатит підтверджень, лікування семаглутидом поновлювати не можна. З обережністю слід застосовувати семаглутид при лікуванні пацієнтів із панкреатитом в анамнезі.
Гіпоглікемія
У пацієнтів, які отримували семаглутид у комплексі із сульфонілсічовиною або інсуліном, може підвищуватися ризик виникнення гіпоглікемії. Ризик гіпоглікемії можна зменшити шляхом зменшення дози сульфонілсічевини або інсуліну на початку лікування семаглутидом (див. розділ «Побічні реакції»).
Діабетична ретинопатія
У пацієнтів з діабетичною ретинопатією, які отримують інсулін і семаглутид, підвищувався ризик розвитку ускладнень діабетичної ретинопатії (див. розділ «Побічні реакції»). Семаглутид необхідно застосовувати з обережністю пацієнтам з діабетичною ретинопатією, які отримують інсулін. За такими пацієнтами слід ретельно спостерігати та лікувати їх згідно з клінічними рекомендаціями. Швидке покращення контролю глюкози було асоційовано з тимчасовим посиленням діабетичної ретинопатії, проте не можна виключати можливість дії інших механізмів.
Вміст натрію
Цей лікарський засіб містить менше 1 ммоль натрію (23 мг)/дозу, тому лікарський засіб можна вважати таким, що не містить натрію.
Застосування у період вагітності або годування груддю.
Жінки репродуктивного віку
Жінкам репродуктивного віку рекомендовано при застосуванні семаглутиду використовувати контрацептиви.
Вагітність
Дослідження на тваринах продемонстрували наявність репродуктивної токсичності (див. розділ «Доклінічні дані із безпеки»). Дані щодо застосування семаглутиду вагітним жінкам обмежені. Тому не слід застосовувати семаглутид у період вагітності. Якщо пацієнтка планує завагітніти або вагітна, застосування семаглутиду слід припинити. З огляду на тривалий період напіввиведення семаглутиду його застосування слід припинити не менше ніж за 2 місяці до запланованої вагітності (див. розділ «Фармакокінетика»).
Годування груддю
При лактації у щурів семаглутид виділявся з молоком. Оскільки не можна виключити ризик для дитини, яка отримує грудне молоко, не слід застосовувати семаглутид протягом періоду годування груддю.
Фертильність.
Вплив семаглутиду на фертильність у людей невідомий. Застосування семаглутиду у самців щурів не впливало на фертильність. У самців щурів спостерігалося збільшення естрального циклу і скорочення кількості овуляцій при дозах, пов'язаних у них з втратою маси тіла (див. розділ «Доклінічні дані з безпеки»).
Здатність впливати на швидкість реакції при керуванні автотранспортом чи іншими механізмами.
Семаглутид не впливає або майже не впливає на здатність керувати автотранспортом або працювати з іншими механізмами. При його застосуванні у комбінації із сульфонілсечовиною або з інсуліном пацієнтам слід рекомендувати вживати заходів безпеки, щоб уникнути розвитку гіпоглікемії під час керування автотранспортом або роботи з іншими механізмами (див. розділ «Особливості застосування»).
Спосіб застосування та дози
Дозування
Початкова доза становить 0,25 мг семаглутиду 1 раз на тиждень. Через 4 тижні дозу слід збільшити до 0,5 мг один раз на тиждень. Для подальшого покращення глікемічного контролю, після застосування дози 0,5 мг 1 раз на тиждень протягом не менше 4 тижнів дозу можна збільшити до 1 мг 1 раз на тиждень.
Доза 0,25 мг семаглутиду не є підтримуючою дозою. Щотижневі дози понад 1 мг не рекомендовані.
Коли лікарський засіб Оземпік доповнюється до метформіну та/або тіазолідиндіону чи до інгібітора натрійзалежного котранспортера глюкози 2-го типу (іНЗКТГ-2), що вже застосовуються, поточна доза метформіну та/або тіазолідиндіону чи іНЗКТГ-2
Коли лікарський засіб Оземпік доповнюється до сульфонілмочевини або інсуліну, що вже застосовуються, слід розглянути можливість зменшення дози сульфонілмочевини або інсуліну, щоб зменшити ризик розвитку гіпоглікемії (див. розділи «Побічні реакції» та «Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами»).
Для корекції дози лікарського засобу Оземпік самостійний контроль рівнів глюкози у крові не потрібен. Самостійний контроль рівнів глюкози в крові потрібен для корекції дози сульфонілсічовини та інсуліну, особливо коли починається застосування лікарського засобу Оземпік і коли зменшується доза інсуліну. Рекомендована покрокова схема зменшення дози інсуліну.
Пропущена доза
Якщо дозу пропущено, її потрібно ввести якнайшвидше протягом 5 днів після пропуску. Якщо вже минуло більше п'яти днів, дозу, що не була введена, слід пропустити та ввести наступну дозу у запланований за схемою день. Таким чином, у кожному випадку пацієнти можуть поновити свою схему регулярного застосування препарату один раз на тиждень.
Якщо необхідно, день щотижневого введення препарату можна змінювати, дотримуючись інтервалу між двома дозами не менше 3 днів (> 72 годин). Після вибору нового дня введення препарату слід продовжувати його застосування за схемою один раз на тиждень.
Особливі групи пацієнтів
Пацієнти літнього віку
Корекція дози за віком не потрібна. Досвід лікування пацієнтів віком ≥ 75 років обмежень (див. розділ «Фармакокінетика»).
Порушення функції нірок
Пацієнтам з легким, помірним чи тяжким порушенням функції нірок корекція дози не потрібна. Досвід застосування семаглутиду пацієнтам із тяжким порушенням функції нирок обмежень. Пацієнтам з термінальною стадією захворювання на нірок застосовувати семаглутид не рекомендовано
Важно! Изображение упаковок товаров приведено в иллюстративных целях и не всегда соответствует внешнему виду упаковок имеющихся в наличии товаров разных производителей и дозировок.
Уточняйте интересующую Вас информацию, в том числе о наличии, производителе и цене товара по телефонам интернет-аптеки.
Данная страница содержит информацию, которая не является основанием для самолечения.
Обязательно получите консультацию специалиста и внимательно ознакомьтесь с инструкцией, находящейся в упаковке с препаратом, перед его применением!
Аналоги:
- Оземпик 1мг шприц-ручка, Novo nordisk pharma gmbh
- Оземпик 0.1 №1 семаглутид шприц-ручка, Ес
- Оземпик 1.0 №1, Ес
- Оземпік/оземпик(семаглутид)р-н д/п/к введ. 0,5мг/0,37мл:шпр-р№1, Данія/румунія
- Оземпік/оземпик(семаглутид)р-н д/п/к введ. 0,5мг/0,37мл:шпр-р№3, Данія/румунія

