Хиты продаж
-
4554,00 грн.Алкеран(Мегвал) фл.50мг.10мл №1 -
1518,00 грн.Блеоцел (Блеомицин) 15мг №1 -
759,00 грн.Зиртек капли 1% 10мл -
5262,40 грн.Прилиджи табл. 60мг №6 -

860,20 грн.Иберогаст капли 20мл
Вальцит табл. п/пл.об.450мг №60
Главная » Каталог лекарств
- Код товара: s238160
- Производитель: Франция/Украина
- Действующее вещество: валганцикловир
- Наличие: нет в наличии
Фармакологічні властивості
Фармакодинаміка.
Валганцикловір є L-валіловим ефіром (проліками) ганцикловіру. Після прийому всередину валганцикловір швидко і активно метаболізується в ганцикловір кишковими і печінковими естеразами. Ганцикловір є синтетичним аналогом 2'-дезоксигуанозину та пригнічує реплікацію вірусів герпесу in vitro та in vivo. Чутливими вірусами людини є цитомегаловірус людини (ЦМВ), вірус простого герпесу 1 і 2 (ВПГ-1 і ВПГ-2), вірус герпесу людини 6, 7 і 8 (ВГЛ-6, ВГЛ-7, ВГЛ-8), вірус Епштейна ? Барр (ВЕБ), вірус вітряної віспи (ВВВ) і вірус гепатиту В (ВГВ).
У ЦМВ-інфікованих клітинах ганцикловір спочатку фосфорилюється вірусною протеїнкіназою pUL97 до ганцикловіру монофосфату. Далі фосфорилювання відбувається клітинними кіназами до отримання ганцикловіру трифосфату, який потім повільно метаболізується внутрішньоклітинно. Було показано, що метаболізм трифосфату відбувається у ВПГ- і ЦМВ-інфікованих клітинах з періодом напіврозпаду 18 годин та між 6 і 24 годинами відповідно після виведення ганцикловіру з позаклітинного простору. Оскільки фосфорилювання переважно залежить від вірусної кінази, фосфорилювання ганцикловіру в основному відбувається в інфікованих вірусом клітинах.
Вірусостатична активність ганцикловіру обумовлена інгібуванням синтезу вірусної ДНК шляхом конкурентного гальмування вбудовування дезоксигуанозину трифосфату в ДНК за допомогою вірусної ДНК-полімерази і включення ганцикловіру трифосфату у вірусну ДНК, що спричиняє термінацію або дуже обмежено – подальше подовження вірусної ДНК.
Противірусна активність
Антивірусна активність in vitro, виміряна як IC50 ганцикловіру проти ЦМВ, знаходиться в діапазоні 0,08 мкM (0,02 мкг/мл) – 14 мкM (3,5 мкг/мл).
Клінічний противірусний ефект препарату Вальцит® був продемонстрований в лікуванні хворих на СНІД із вперше діагностованим ЦМВ-ретинітом. Кількість пацієнтів з виділенням ЦМВ в сечі знизилося з 46 % (32/69) на початку дослідження до 7 % (4/55) у наступні чотири тижні лікування препаратом Вальцит®.
Фармакокінетика.
Фармакокінетичні властивості валганцикловіру вивчали у ВІЛ- та ЦМВ-серопозитивних пацієнтів, пацієнтів, хворих на СНІД і ЦМВ-ретиніт, і у пацієнтів після трансплантації паренхіматозних органів.
Пропорційність дозі показника AUC ганцикловіру після застосування 450–2625 мг валганцикловіру була продемонстрована тільки за умови прийому після вживання їжі.
Всмоктування
Валганцикловір є проліками ганцикловіру. Він добре всмоктується зі шлунково-кишкового тракту і швидко та активно метаболізується в стінці кишечнику і в печінці в ганцикловір. Системна експозиція валганцикловіру транзиторна і низька. Абсолютна біодоступність ганцикловіру з валганцикловіру приблизно 60 % у всіх групах пацієнтів, а підсумкова експозиція ганцикловіру аналогічна такій після його внутрішньовенного введення (див. нижче). Для порівняння, біодоступність ганцикловіру після прийому 1000 мг ганцикловіру перорально (у вигляді капсул) становить 6–8 %.
Валганцикловір у ВІЛ-позитивних, ЦМВ-позитивних пацієнтів
Показники системної експозиції у ВІЛ-позитивних, ЦМВ-позитивних пацієнтів після введення ганцикловіру і валганцикловіру два рази на добу протягом одного тижня наведено у таблиці 1.
Таблиця 1. Фармакокінетичні параметри у ВІЛ-позитивних, ЦМВ-позитивних пацієнтів після введення ганцикловіру і валганцикловіру два рази на добу протягом одного тижня
|
Параметр |
Ганцикловір (5 мг/кг, внутрішньовенно) n = 18 |
Валганцикловір (900 мг, перорально) n = 25 |
|
|
Ганцикловір |
Валганцикловір |
||
|
AUC(0-12 год) (мкг·год/мл/мл) |
28,6 ± 9,0 |
32,8 ± 10,1 |
0,37 ± 0,22 |
|
Сmax (мкг/мл) |
10,4 ± 4,9 |
6,7 ± 2,1 |
0,18 ± 0,06 |
Ефективність ганцикловіру у збільшенні часу до прогресування ЦМВ-ретиніту, як було показано, корелює з показником системної експозиції (AUC).
Валганцикловір у пацієнтів після трансплантації паренхіматозних органів
Сталий стан системної експозиції ганцикловіру у пацієнтів після трансплантації паренхіматозних органів після щоденного перорального введення ганцикловіру і валганцикловіру наведено у таблиці 2.
Таблиця 2. Фармакокінетичні параметри у пацієнтів після трансплантації паренхіматозних органів після щоденного перорального прийому ганцикловіру і валганцикловіру
|
Параметр |
Ганцикловір (1000 мг 2 рази на добу) n = 82 |
Валганцикловір (900 мг 1 раз на добу) n = 161 |
|
Ганцикловір |
||
|
AUC(0-24 год) (мкг·год/мл/мл) |
28,0 ± 10,9 |
46,3 ± 15,2 |
|
Сmax (мкг/мл) |
1,4 ± 0,5 |
5,3 ± 1,5 |
Системна експозиція ганцикловіру в серці, нирках і печінці реципієнтів була подібна після перорального прийому валганцикловіру відповідно до алгоритму дозування з урахуванням ниркової функції.
Ефект їжі
Коли валганцикловір застосовували з їжею в рекомендованій дозі 900 мг, були встановлені більш високі, ніж при прийомі натще, значення як середньої AUC ганцикловіру (близько 30 %), так і середньої Cmax ганцикловіру (близько 14 %). Крім того, індивідуальні відмінності у впливі ганцикловіру зменшуються при прийомі препарату Вальцит® з їжею. В клінічних дослідженнях Вальцит® застосовувався тільки з їжею. Тому рекомендується Вальцит® застосовувати під час їди (див. розділ «Спосіб застосування та дози»).
Розподіл
Через швидке перетворення валганцикловіру на ганцикловір зв’язування з білками валганцикловіру не було визначено. Сталий об’єм розподілу (Vd) ганцикловіру після внутрішньовенного введення становив 0,680 ± 0,161 л/кг (n = 114). Для ганцикловіру, що застосовується внутрішньовенно, об’єм розподілу корелює із масою тіла пацієнта і становить в рівноважному стані 0,54–0,87 л/кг. Ганцикловір проникає в спинномозкову рідину. При концентраціях ганцикловіру від 0,5 до 51 мкг/мл зв’язування з білками плазми становило 1–2 %.
Біотрансформація
Валганцикловір швидко і активно метаболізується в ганцикловір; жодних інших метаболітів не було виявлено. Ганцикловір значною мірою не метаболізується.
Виведення
Після перорального прийому валганцикловір швидко гідролізується до ганцикловіру. У пацієнтів з нормальною функцією нирок більше ніж 90 % внутрішньовенно введеного ганцикловіру виводилося з сечею у незміненому вигляді протягом 24 годин. У пацієнтів з нормальною функцією нирок після застосування валганцикловіру післяпікові концентрації ганцикловіру у плазмі знижувалися з періодом напіввиведення в діапазоні від 0,4 год до 2,0 год.
Фармакокінетика в особливих клінічних популяціях
Діти
У дослідженнях фармакокінетики та безпеки II фази за участю дітей після трансплантації паренхіматозних органів (у віці від 4 місяців до 16 років, n = 63) валганцикловір (порошок для орального розчину або таблетки) застосовували один раз на день протягом періоду до 100 днів. Параметри фармакокінетики були схожі за типом органів і віком та порівнянні з такими у дорослих. Популяційне фармакокінетичне моделювання показало біодоступність близько 60%. На кліренс позитивно впливають площа поверхні тіла і функція нирок.
У дослідженні фармакокінетики і безпеки I фази за участю дітей після трансплантації серця (віком від 3 тижнів до 125 днів, n = 14) валганцикловір (порошок для орального розчину) застосовували один раз на день протягом двох днів дослідження. За популяційною оцінкою фармакокінетики середня біодоступність становила 64%.
Порівняння результатів цих двох досліджень і фармакокінетичних результатів у дорослого населення показує, що діапазони AUC0-24 год були дуже схожі у всіх вікових групах, у тому числі у дорослих. Середні значення AUC0-24 год і Cmax були також схожі у вікових групах дітей віком <12 років, хоча спостерігалася тенденція зниження середніх значень AUC0-24год і Cmax у дітей усього вікового діапазону, що, як виявлено, корелює зі збільшенням віку. Ця тенденція була більш очевидною для середніх значень кліренсу і періоду напіввиведення (t½). Проте це було очікувано, оскільки кліренс залежить від змін маси, зросту і пов'язаної зі зростом ниркової функції, що було показано за допомогою популяційного фармакокінетичного моделювання.
У таблиці 3 узагальнено модель-оціночні діапазони AUC0-24 год ганцикловіру з цих двох досліджень, а також середнє і стандартне відхилення значення AUC0-24 год, Cmax, кліренсу і t½ у відповідних дитячих вікових групах у порівнянні з дорослими.
Таблиця 3. Фармакокінетичні параметри ганцикловіру у відповідних дитячих вікових групах у порівнянні з дорослими
|
Фармакокінетичний параметр |
Дорослі* |
Діти |
||||
|
≥ 18 років (n=160) |
< 4 міс. (n=14) |
4 міс. – ≤ 2 р. (n=17) |
> 2 – < 12 р. (n=21) |
≥ 12 р. – 16 р. (n=25) |
||
|
AUC0-24 год (мкг·год/мл) |
46,3 ± 15,2 |
68,1 ± 19,8 |
64,3 ± 29,2 |
59,2 ± 15,1 |
50,3 ± 15,0 |
|
|
Діапазон AUC0-24 год |
15,4–116,1 |
34–124 |
34–152 |
36–108 |
22–93 |
|
|
Cmax (мкг/мл) |
5,3 ± 1,5 |
10,5 ± 3,36 |
10,3 ± 3,3 |
9,4 ± 2,7 |
8,0 ± 2,4 |
|
|
Кліренс (л/год) |
12,7 ± 4,5 |
1,25 ± 0,473 |
2,5 ± 2,4 |
4,5 ± 2,9 |
6,4 ± 2,9 |
|
|
t½ (год) |
6,5 ± 1,4 |
1,97 ± 0,185 |
3,1 ±1,4 |
4,1 ± 1,3 |
5,5 ± 1,1 |
|
*Витяг зі звіту дослідження PV 16000.
Разова добова доза препарату Вальцит® в обох вищезазначених дослідженнях визначалася за площею поверхні тіла (ППТ) і кліренсом креатиніну (КК), вирахуваним за модифікованою формулою Шварца:
Доза для дитини (мг) = 7 × ППТ × КК (див. формулу для ППТ за Мостеллером і формулу для КК за Шварцом), де:
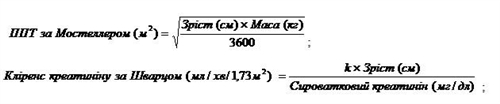
де k = 0,45* для пацієнтів віком <2 років, k = 0,55 для хлопчиків у віці від 2 до 13 років і дівчаток віком від 2 до 16 років, k = 0,7 для хлопчиків у віці від 13 до 16 років.
Доза не повинна перевищувати 900 мг дози для дорослих. Якщо розрахунковий кліренс креатиніну за Шварцом перевищує 150 мл/хв/1,73 м2, то в рівнянні слід використовувати максимальне значення 150 мл/хв/1,73 м2.
Фармакокінетику ганцикловіру після введення валганцикловіру (порошку для орального застосування) також оцінили у двох дослідженнях у новонароджених і немовлят з симптоматичною вродженою ЦМВ-інфекцією. У першому дослідженні 24 новонароджених у віці від 8 до 34 днів отримували ганцикловір 6 мг/кг внутрішньовенно два рази на день. Пацієнти потім отримували валганцикловір перорально, доза валганцикловіру, порошку для орального розчину, становила від 14 мг/кг до 20 мг/кг двічі на день, загальна тривалість лікування становила 6 тижнів. Доза валганцикловіру, порошку для орального розчину, 16 мг/кг двічі на день забезпечує експозицію ганцикловіру, порівнянну з такою при застосуванні 6 мг/кг внутрішньовенно двічі на день у новонароджених, а також аналогічну ефективній внутрішньовенній дозі для дорослих 5 мг/кг.
У другому дослідженні 109 новонароджених у віці від 2 до 30 днів отримували по 16 мг/кг валганцикловіру, порошку для орального розчину, два рази на добу протягом 6 тижнів, а потім 96 зі 109 зареєстрованих пацієнтів були рандомізовані для продовження прийому валганцикловіру або плацебо протягом 6 місяців. Проте середня AUC0-12год була нижче, ніж середні значення AUC0-12год у першому дослідженні. У таблиці 4 наведено середні значення AUC, Cmax і t½, включаючи стандартні відхилення у порівнянні з дорослими.
Таблиця 4. Фармакокінетичні параметри ганцикловіру і валганцикловіру у дітей у порівнянні з дорослими
|
Фармакокінетичний параметр |
Дорослі |
Новонароджені і немовлята |
||
|
|
5 мг/кг ГАН Разова доза (n = 8) |
6 мг/кг ГАН Два рази на день (n=19) |
16 мг/кг ВАЛ Два рази на день (n=19) |
16 мг/кг ВАЛ Два рази на день (n = 100) |
|
AUC0-∞ (мкг · год/л) |
25,4 ± 4,32 |
- |
- |
- |
|
AUC0-12год (мкг · год/л) |
- |
38,2 ± 42,7 |
30,1 ± 15,1 |
20,85 ± 5,40 |
|
Сmax (мкг · год/мл) |
9,03 ± 1,26 |
12,9 ± 21,5 |
5,44 ± 4, 04 |
- |
|
t ½ (год) |
3,32 ± 0,47 |
2,52 ± 0, 55 |
2,98 ± 1, 26 |
2,98 ± 1,12 |
ГАН – ганцикловір внутрішньовенно.
ВАЛ – валганцикловір перорально.
Ці дані занадто обмежені, щоб зробити висновки щодо ефективності або надати рекомендації щодо дозування для дітей із вродженою ЦМВ-інфекцією.
Пацієнти літнього віку
Дослідження фармакокінетики валганцикловіру або ганцикловіру у дорослих віком від 65 років не проводилися (див. розділ «Спосіб застосування та дози»).
Пацієнти з порушенням функції нирок
Фармакокінетика ганцикловіру після прийому одноразової пероральної дози 900 мг валганцикловіру оцінювалась у 24 добровольців з порушенням функції нирок без інших патологій.
Таблиця 5. Фармакокінетичні показники ганцикловіру після прийому одноразової пероральної дози 900 мг препарату Вальцит® у формі таблеток у пацієнтів з різними ступенями порушення функції нирок.
|
Розрахунковий кліренс креатиніну (мл/хв) |
N |
Встановлений кліренс (мл/хв), середнє значення ± СВ |
AUCостанній (мкг · год/мл), середнє значення ± СВ |
Період напіввиведення (год), середнє значення ± СВ |
|
51–70 |
6 |
249 ± 99 |
49,5 ± 22,4 |
4,85 ± 1,4 |
|
21–50 |
6 |
136 ± 64 |
91,9 ± 43,9 |
10,2 ± 4,4 |
|
11–20 |
6 |
45 ± 11 |
223 ± 46 |
21,8 ± 5,2 |
|
≤ 10 |
6 |
12,8 ± 8 |
366 ± 66 |
67,5 ± 34 |
Зниження функції нирок призводить до зниження кліренсу ганцикловіру з валганцикловіру з відповідним збільшенням термінального періоду напіввиведення. Таким чином, для пацієнтів з порушенням функції нирок потрібна корекція дози (див. розділи «Спосіб застосування та дози» та «Особливості застосування»).
Пацієнти, які перебувають на гемодіалізі
Для пацієнтів, які перебувають на гемодіалізі, рекомендації щодо дози препарату Вальцит® не можуть бути надані, оскільки індивідуальна доза препарату Вальцит® для цих пацієнтів менша, ніж 450 мг, що містяться в таблетці. Таким чином, Вальцит® у формі таблеток, вкритих плівковою оболонкою, не слід застосовувати цим хворим (див. розділи «Спосіб застосування та дози», «Особливості застосування»).
Стабільні пацієнти після трансплантації печінки
Фармакокінетика ганцикловіру, утвореного з валганцикловіру, у стабільних пацієнтів після трансплантації печінки вивчалася в одному відкритому перехресному дослідженні (N=28), що складалося із 4 частин. Біодоступність ганцикловіру, утвореного з валганцикловіру, після разової дози 900 мг валганцикловіру, який застосовували після прийому їжі, становила приблизно 60%. AUC0?24год ганцикловіру була зіставною з такою, що досягалася після внутрішньовенного введення ганцикловіру у дозі 5 мг/кг пацієнтам після трансплантації печінки.
Пацієнти з порушенням функції печінки
Безпека та ефективність препарату Вальцит® не були вивчені у пацієнтів з порушенням функції печінки. Печінкова недостатність не повинна впливати на фармакокінетику ганцикловіру, оскільки препарат виводиться нирками, тому жодні конкретні рекомендації з дозування не надаються.
Пацієнти з муковісцидозом
У фармакокінетичному дослідженні I фази за участю пацієнтів після трансплантації легень з муковісцидозом (МВ) або без такого 31 пацієнт (16 з МВ/15 без МВ) отримав після трансплантації профілактику препаратом Вальцит® у дозі 900 мг/добу. Дослідження показало, що муковісцидоз не мав статистично значущого впливу на загальну середню системну експозицію ганцикловіру в легенях пацієнтів після трансплантації. Експозиція ганцикловіру в легенях пацієнтів після трансплантації була порівнянною з такою, що продемонструвала ефективність у профілактиці ЦМВ-інфекції у інших пацієнтів після трансплантації органів.
Показання
- Індукція і підтримувальне лікування цитомегаловірусного ретиніту у пацієнтів з синдромом набутого імунодефіциту (СНІД).
- Профілактика ЦМВ-інфекції у ЦМВ-негативних пацієнтів, яким проведено трансплантацію паренхіматозних органів від ЦМВ-позитивних донорів.
Протипоказання
- Підвищена чутливість до валганцикловіру, ганцикловіру або до будь-якої з допоміжних речовин.
- Період годування груддю (див. розділ «Застосування у період вагітності або годування груддю»).
Взаємодія з іншими лікарськими засобами та інші види взаємодії
Взаємодії лікарських засобів з валганцикловіром
Фармакокінетичні взаємодії
Пробенецид
Одночасне пероральне застосування пробенециду статистично істотно зменшує нирковий кліренс ганцикловіру (20%), що статистично достовірно збільшує його експозицію (40%). Це пояснюється механізмом взаємодії – конкуренцією за канальцеву ниркову екскрецію. Необхідно ретельно спостерігати за хворими, які одночасно приймають пробенецид та Вальцит®, щоб уникнути токсичного впливу ганцикловіру.
Диданозин
Встановлено послідовне підвищення концентрацій диданозину у плазмі у разі одночасного застосування з внутрішньовенним введенням ганцикловіру. Під час застосування доз 5 і 10 мг/кг/добу внутрішньовенно спостерігалося підвищення AUC (площа під кривою «концентрація-час») диданозину в діапазоні від 38 до 67%, що підтверджує фармакокінетичну взаємодію у разі одночасного застосування цих препаратів. Суттєвий вплив на концентрації ганцикловіру не спостерігався. Слід здійснювати ретельний моніторинг пацієнтів для виявлення проявів токсичності диданозину, зокрема пацієнтів з панкреатитом (див. розділ «Особливості застосування»).
Інші антиретровірусні лікарські засоби
Ізоферменти цитохрому P450 не беруть участі у фармакокінетиці ганцикловіру. Таким чином, не очікуються фармакокінетичні взаємодії з інгібіторами протеази та ненуклеозидними інгібіторами зворотної транскриптази.
Фармакодинамічні взаємодії
Іміпенем-циластатин
Повідомлялося про виникнення судом у пацієнтів, які одночасно приймали ганцикловір та іміпенем-циластатин, і фармакодинамічна взаємодія між цими двома засобами не може бути зменшена. Ці препарати можуть застосовуватися одночасно, тільки якщо потенційна користь переважає потенційні ризики (див. розділ «Особливості застосування»).
Зидовудин
І зидовудин, і ганцикловір можуть спричиняти нейтропенію та анемію. У разі одночасного застосування цих засобів можлива фармакодинамічна взаємодія. Деякі пацієнти можуть не переносити одночасну терапію у разі отримання повної дози (див. розділ «Особливості застосування»).
Можливі взаємодії з лікарськими засобами
Токсичність може підвищуватися у разі одночасного застосування ганцикловіру/валганцикловіру з іншими лікарськими засобами, які є мієлосупресорами або призводять до порушення функції нирок. До таких засобів належать нуклеозидні (наприклад зидовудин, диданозин, ставудин) та нуклеотидні аналоги (наприклад тенофовір, адефовір), імуносупресанти (наприклад циклоспорин, такролімус, мофетилу мікофенолат), антинеопластичні засоби (наприклад доксорубіцин, вінбластин, вінкристин, гідроксисечовина) та антибактеріальні засоби (триметоприм/сульфонаміди, дапсон, амфотерицин B, флуцитозин, пентамідин). Таким чином, зазначені лікарські засоби слід призначати одночасно з валганцикловіром лише у разі, коли очікувана користь від лікування переважає можливі ризики (див. розділ «Особливості застосування»).
Важно! Изображение упаковок товаров приведено в иллюстративных целях и не всегда соответствует внешнему виду упаковок имеющихся в наличии товаров разных производителей и дозировок.
Уточняйте интересующую Вас информацию, в том числе о наличии, производителе и цене товара по телефонам интернет-аптеки.
Данная страница содержит информацию, которая не является основанием для самолечения.
Обязательно получите консультацию специалиста и внимательно ознакомьтесь с инструкцией, находящейся в упаковке с препаратом, перед его применением!
Аналоги:
- Вальцит 450мг №60 таб., Хоффманн_ля рош лтд швейцария
- Валхит 450мг №60 вальцит валганцикловир, Accord польша
- Валган valgan валганцикловир 450мг №4, Индия
- Валганцикловир (валган) / вальцит 450мг №60, Ципла
- Цитовир (валганцикловир) 450мг табл. №60, Farma-tek ilac, турция
- Вальцит тб 450мг №60, Хоффман-лярош
- Вальцит тб 450мг №60, Хоффман-лярош
- Вальцит тб 450мг №60, Хоффман-лярош
- Вальцит (валганцикловир) 450 мг, 60 шт., Hoffmann-la roche, швейцария
- Валганир (валганцикловир) 450мг табл. №60, Sanofi saglik, турция
- Авалцепт (валганцикловир) 450мг №60, Ali raif ilac, турция
- Цитовир (валганцикловир) 450мг табл. №60 вальцит, Farma-tek ilac, турция
- Вальцит тб 450мг №60, Хоффман-лярош
- Вальцит тб 450мг №60, Хоффман-лярош
- Вальцит тб 450мг №60, Хоффман-лярош
- Вальцит табл. п/пл.об.450мг №60, Роше, франция
- Ганцил таб.в/о 450мг№60 конт., Гетеро лабз лимитед индия

